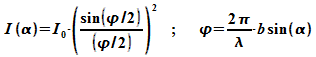
Werden Wellen an einem Spalt der Breite b gebeugt, so ergibt sich die Intensitätsverteilung
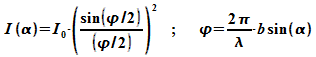
Die
Minima ergeben sich aus 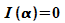 .
Diese Bedingung ist erfüllt wenn
.
Diese Bedingung ist erfüllt wenn 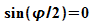 ist, also
ist, also
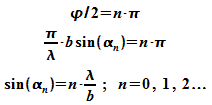
Als
Beispiel wird hier Licht der Wellenlänge 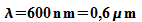 betrachtet, das an Spalten unterschiedlicher Breite b gebeugt
wird:
betrachtet, das an Spalten unterschiedlicher Breite b gebeugt
wird:
|
|
|
|
|
|
|
|
|
|
|
|
Wie
beim Doppelspaltversuch baut sich auch beim Einzelspalt für
Licht und Elektronen die Verteilung der Lokalisationen stochastisch
auf und wird nach hinreichend langer Zeit durch die
Intensitätsverteilung 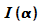 beschrieben.
beschrieben.
Werner Heisenberg (Nobelpreis 1932) untersuchte 1926 das Verhalten von Elektronen am Spalt mit folgender Überlegung:
|
|
Zur Bestimmung des Ortes von Elektronen wird ein Spalt der Breite b verwendet, auf den ein Elektronenstrahl fällt. Alle Elektronen im Strahl seien einheitlich präpariert, d.h. alle Elektronen besitzen den scharfen Impuls
Im Teilchenmodell ist der Ort eines durch den Spalt gehenden
Elektrons nun mit der Unbestimmtheit |
|
|
Im Wellenmodell werden die Elektronen mit de Broglie-Wellen der Wellenlänge
beschrieben, und es ergibt sich Beugung am Spalt. Das
bedeutet: Die Elektronen erhalten am Spalt stochastisch verteilte
Querimpulse |
Um
diesen Mittelwert abzuschätzen nahm Heisenberg den Betrag  an, der klassische Teilchen zum ersten Minimum unter dem Winkel
an, der klassische Teilchen zum ersten Minimum unter dem Winkel 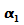 führen würde:
führen würde:
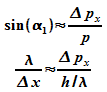
Es folgt also:
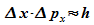
Das bedeutet: Der Versuch, den Ort von Elektronen durch Verkleinerung der Spaltbreite genauer zu bestimmen, führt zu einer Vergrößerung der Unbestimmtheit, mit der man den Impuls der Elektronen kennt. Umgekehrt gilt: Wenn der Impuls genauer bestimmt werden soll, dann muss die Spaltbreite und damit die Unbestimmtheit des Ortes vergrößert werden. Ort und Impuls können nicht gleichzeitig beliebig genau bestimmt werden.
|
Heisenberg'sche Unbestimmtheitsrelation: Unbestimmtheiten sind Mittelwerte der Beträge von
Messwerten
einer einheitlich präparierten Gesamtheit von Quantenobjekten.
Für die
Unbestimmtheiten
Entsprechendes gilt für die y- und z-Koordinate. |
Das
Produkt 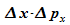 kann also nie Null werden. Der Versuch, den Ort scharf zu bestimmen
(
kann also nie Null werden. Der Versuch, den Ort scharf zu bestimmen
(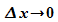 )
führt zu völliger Unbestimmtheit des Impulses (
)
führt zu völliger Unbestimmtheit des Impulses (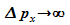 ).
Umgekehrt führt der Versuch einer scharfen Impulsbestimmung (
).
Umgekehrt führt der Versuch einer scharfen Impulsbestimmung (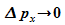 )
zu völliger Unbestimmtheit im Ort (
)
zu völliger Unbestimmtheit im Ort (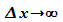 ).
).
1. Teilchenbahnen
Eine
direkte Folge der Unbestimmtheitsrelation ist, dass es im Bereich
atomarer Größenordnungen keine Bahnen von Teilchen mehr
gibt. Für klassische Teilchen kann die Bewegung mit der
Bahnkurve 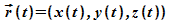 und der Geschwindigkeit
und der Geschwindigkeit 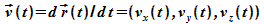 bzw dem Impuls
bzw dem Impuls 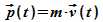 beschrieben werden. Dabei werden Ort und Impuls gleichzeitig exakt
angegeben, was bei Quantenobjekten jedoch nicht mehr möglich
ist. Als Beispiel werden eine Gewehrkugel und ein Elektron
betrachtet, die sich mit 500 m/s bewegen:
beschrieben werden. Dabei werden Ort und Impuls gleichzeitig exakt
angegeben, was bei Quantenobjekten jedoch nicht mehr möglich
ist. Als Beispiel werden eine Gewehrkugel und ein Elektron
betrachtet, die sich mit 500 m/s bewegen:
|
|
Gewehrkugel |
Elektron |
|
Masse |
|
|
|
Orts-Unbestimmtheit (gesetzt) |
|
|
|
Impuls-Unbestimmtheit
|
|
|
|
Geschwindigkeits-Unbestimmtheit
|
|
|
Dies Beispiel verdeutlicht: Für makroskopische Körper wie die Gewehrkugel ist die Unbestimmtheit der Geschwindigkeit unmessbar klein, so dass es gerechtfertigt ist, sie in der klassischen Mechanik zu vernachlässigen. Bei Quantenobjekten ist sie dagegen so groß, dass der Begriff der Bahn jeden Sinn verliert.
2. Nullpunktsenergie
Eine
wichtige Konsequenz der Heisenberg'schen Unbestimmtheitsrelationen
ist die Existenz der sogenannten Nullpunktsenergie (auch:
Lokalisationsenergie), die ein Quantenobjekt immer dann besitzt, wenn
es in einem bestimmten Raumbereich eingeschlossen ist. Beispiel: Ein
Elektron sei in einem eindimensionalen Bereich der Länge L
eingeschlossen. Seine Unbestimmtheit im Ort ist dann 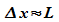 .
Aus der Unbestimmtheitsrelation ergibt sich für die
Unbestimmtheit im Impuls:
.
Aus der Unbestimmtheitsrelation ergibt sich für die
Unbestimmtheit im Impuls:
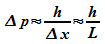
Die
Impulse des Elektrons liegen zwischen 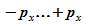 ,
also ist
,
also ist 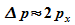 ,
und es folgt
,
und es folgt
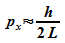
Für die kinetische Energie des Elektrons ergibt sich damit
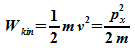
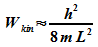
Bei dreidimensionalen Problemen ist mit 3 zu multiplizieren:

Für Abschätzungen wird auch die Form
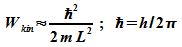
verwendet.
Die
Nullpunktsenergie besitzen Teilchen auch am absoluten
Temperaturnullpunkt T = 0. Bei Verkleinerung des
Raumbereiches, in dem ein Teilchen eingeschlossen ist, wächst
diese Energie stark an. Beim sogenannten Beta-Zerfall radioaktiver
Elemente wird beobachtet, dass die zerfallenden Atomkerne Elektronen
aussenden. Zu Beginn der Untersuchungen dieser Vorgänge wurde
angenommen, dass der Atomkern also Elektronen enthalte. Nun sind
Kerne von der Größenordnung 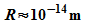 ,
und die Elektronen hätten dann eine Nullpunktsenergie von etwa
,
und die Elektronen hätten dann eine Nullpunktsenergie von etwa
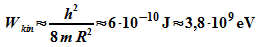
Die gemessenen Energien von Elektronen aus dem Beta-Zerfall liegen aber nur in der Größenordnung bis 1 MeV. Somit können die Elektronen nicht schon vor dem Zerfall im Kern vorhanden gewesen sein.
3. Größe und Grundzustandsenergie des Wasserstoffatoms
Das Elektron im Wasserstoffatom bewegt sich im Feld des Protons. Es besitzt daher kinetische Energie und potentielle Energie:
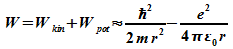
Die
minimale Energie ergibt sich aus 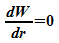 :
:
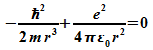
Für die Größe des H-Atoms folgt damit der sogenannte Bohr-Radius:
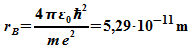
Die Energie des Elektrons im Grundzustand ergibt sich für den Bohr-Radius:
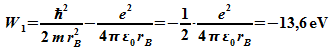
Dies ist in Übereinstimmung mit der gemessenen Ionisierungsenergie des H-Atoms.
4. Chemische Energie
Chemische
Prozesse spielen sich in der Atomhülle ab. Hier liegen typische
Energien bei etwa 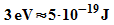 pro Atom. In 1 mol befinden sich
pro Atom. In 1 mol befinden sich 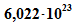 Atome, so dass sich die chemische Energie von etwa
Atome, so dass sich die chemische Energie von etwa 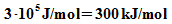 ergibt. Beispiel: Kohlenstoff hat einen Heizwert von
ergibt. Beispiel: Kohlenstoff hat einen Heizwert von 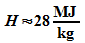 .
Für Kohlenstoff gilt
.
Für Kohlenstoff gilt 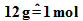 ,
also
,
also 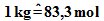 .
Damit wird der Heizwert
.
Damit wird der Heizwert 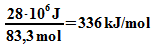 ,
was zu der Abschätzung passt.
,
was zu der Abschätzung passt.
5. Kerne
Die
Protonen in den Kernen sind in einem Bereich der
Größenordnung
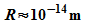 eingeschlossen. Mit der
Protonenmasse
eingeschlossen. Mit der
Protonenmasse 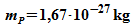 ergibt sich die Abschätzung der Nullpunktsenergie
ergibt sich die Abschätzung der Nullpunktsenergie
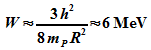
Dies
ist die Größenordnung der Energien von 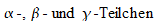 ,
die bei radioaktiven Prozessen den Kern verlassen.
,
die bei radioaktiven Prozessen den Kern verlassen.
Übungen
|
empfohlene Aufgaben |
Lösungen |
|
S.431, A1 |
0,006% bzw. 6% |
|
S.431, A2 |
a) b = 0,14 mm b) D = 45,6 km |
|
S.431, A3 |
|